互聯網新聞信息許可證服務編號:61120190002
陜西互聯網違法和不良信息舉報電話:029-63907152
2025-07-23 19:13:53 來源:陽光網-陽光報
分享到

陽光訊(記者 鄭亞雷)7月18日,西安交通大學第一附屬醫院作為第一完成單位,由腫瘤放療科韓蘇夏教授團隊主導完成重要研究成果《A ROS-mediated Oxidation-O-GlcNAcylation cascade governs ferroptosis》(活性氧介導的氧化和O-糖基化級聯反應調控鐵死亡),在細胞生物學領域頂級期刊《Nature Cell Biology》發表。該研究首次揭示肝癌細胞通過ROS-OGT-FOXK2-SLC7A11信號軸抵抗放化療的關鍵機制,為破解腫瘤治療抵抗難題提供了全新干預靶點,標志著西安交通大學第一附屬醫院在腫瘤表觀遺傳調控領域取得突破性進展。

研究背景
鐵死亡(ferroptosis)是一種依賴鐵離子積累和脂質過氧化的新型細胞死亡方式,與腫瘤發生和放化療敏感性密切相關。盡管活性氧(ROS)被廣泛認為在脂質過氧化及鐵死亡中發揮關鍵作用,但癌細胞如何感知ROS,并逆轉藥物誘導的細胞死亡(包括但不限于鐵死亡)的機制仍不清楚。O-GlcNAc糖基化是一種重要的翻譯后修飾(PTM),由O-GlcNAc轉移酶(OGT)將UDP-GlcNAc添加至靶蛋白的絲氨酸(Ser)或蘇氨酸(Thr)殘基上(1)。前不久,Ma Junfeng團隊和裴華東團隊也合作發現O-GlcNAc修飾也可發生在蛋白質的酪氨酸殘基(Tyr)上(2)。O-GlcNAc修飾可動態調控基因轉錄、蛋白功能及穩定性,同時對營養狀態和氧化應激具有感應作用,并廣泛參與細胞中的關鍵信號通路和代謝調控(3)。已有研究表明,O-GlcNAc修飾與鐵死亡密切相關(4),但具體分子機制尚不清楚。
OGT作為氧化應激的感受器
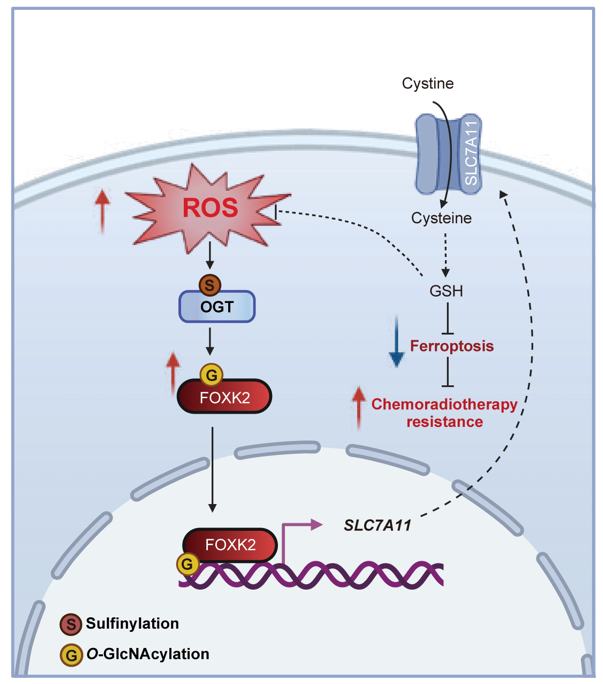
前期研究發現,在鐵死亡誘導或氧化應激條件下,肝癌細胞中O-GlcNAc修飾水平顯著升高,然而OGT和OGA蛋白表達水平未發生明顯變化,鐵死亡也未影響O-GlcNAc供體分子UDP-GlcNAc的含量,提示O-GlcNAc修飾水平上升可能源于OGT酶活性的增強。進一步通過LC-MS/MS分析發現,活性氧(ROS)升高可氧化OGT催化結構域中保守的Cys845位點,形成亞磺酸化修飾。Cys845的亞磺酸化修飾顯著增強OGT的酶活性,從而促進底物蛋白的O-GlcNAc修飾。
OGT抑制鐵死亡相關分子機制
進一步研究表明,OGT通過促進SLC7A11的轉錄,增強細胞對胱氨酸的攝取,從而抵抗鐵死亡。敲低OGT可顯著下調SLC7A11的表達,而過表達OGT或抑制其去糖基化酶OGA則可增強SLC7A11的表達水平。功能研究顯示,OGT敲低可降低細胞對半胱氨酸的攝取,導致谷胱甘肽(GSH)含量下降,同時促進脂質過氧化物(ROS)的積累,從而增強細胞對Erastin的敏感性。機制研究進一步發現,OGT通過O-GlcNAc修飾轉錄因子FOXK2,增強其對SLC7A11的轉錄。LC-MS/MS分析顯示,FOXK2在Ser424位點發生O-GlcNAc修飾,這一修飾促進其與核轉運蛋白importin α7/8的相互作用,從而增強FOXK2的核定位能力。進入細胞核后的FOXK2可特異性結合于SLC7A11啟動子區域,顯著上調該胱氨酸轉運體的表達,進而促進胱氨酸攝取、維持GSH合成、清除脂質ROS,從而有效抑制鐵死亡。
OGT-FOXK2-SLC7A11信號軸與腫瘤細胞放化療抵抗
缺失FOXK2的O-GlcNAc修飾顯著削弱其在體內外促進肝細胞癌(HCC)生長的能力。無論是敲除FOXK2還是表達不可被修飾的突變體(S424A),均可顯著抑制小鼠移植瘤的生長;而鐵死亡抑制劑UAMC-3203可部分逆轉這一抑瘤效應。在臨床樣本中,肝細胞癌組織中OGT、FOXK2和SLC7A11的表達均明顯上調,且FOXK2與SLC7A11蛋白水平、OGT與SLC7A11蛋白水平呈顯著正相關。此外,研究還發現,缺失FOXK2 O-GlcNAc修飾可增強細胞對5-FU和放療的敏感性。在多種放化療抵抗的HCC細胞模型中,ROS水平、OGT活性、FOXK2 O-GlcNAcylation和SLC7A11表達均顯著上調,提示OGT–FOXK2–SLC7A11信號軸在腫瘤細胞抵抗放化療中起關鍵作用。
結論
綜上所述,本研究揭示在治療抵抗的肝癌細胞中,OGT被顯著激活,并作為ROS的感應器,驅動O-GlcNAc信號增強。激活的ROS–OGT–FOXK2–SLC7A11信號軸通過抑制鐵死亡,促進癌細胞放化療抵抗。靶向該通路有望重新激活鐵死亡,為克服腫瘤治療抵抗提供全新策略。
本研究由西安交通大學第一附屬醫院韓蘇夏教授團隊主導完成樣本分析與機制驗證。西安交通大學第一附屬醫院博士研究生張赫萌為第一作者、馬佳琳為共同第一作者,西安交通大學第一附屬醫院韓蘇夏教授、喬治城大學醫學中心裴華東教授、武漢大學人民醫院李娟娟教授與張恒教授,以及喬治城大學醫學中心馬俊峰教授為共同通訊作者。喬治城大學的Gary Kupfer教授、Peng Yihan博士等合作者也對本研究作出了重要貢獻。
韓蘇夏教授表示:“這項研究首次將氧化應激感應機制與表觀遺傳修飾調控網絡相連接,為理解腫瘤放化療抵抗提供了全新視角。團隊將繼續深化轉化研究,推動基礎發現向臨床應用的跨越。”